Staphylococcus aureus Bakteriämie: Unterschied zwischen den Versionen
Keine Bearbeitungszusammenfassung |
|||
| (10 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 5: | Zeile 5: | ||
==Erreger== | ==Erreger== | ||
<ol><li>grampositives kugelförmiges Bakterium</li><li>fakultativ pathogen</li><li>mikroskopische Darstellung als Haufenkokken</li><li>bei ca. 20% der Bevölkerung auf Haut und im Rachen nachweisbar</li><li>bildet verschiedene Enzyme</li><ul><li>Koagulase-positiv</li><li>Hämolysine</li><li>Kollagenase</li><li>Leukozidine</li></ul><li>Staph. aureus kann Biofilm bilden</li><li>Bakterium kann als "schlafender Phänotyp" im Gewebe persistieren = small colony variants</li><li>Möglichkeit der Ausbildung verschiedenster Resistenzmechanismen (MRSA)</li></ol> | <ol><li>grampositives kugelförmiges Bakterium</li><li>fakultativ pathogen</li><li>mikroskopische Darstellung als Haufenkokken</li><li>bei ca. 20% der Bevölkerung auf Haut und im Rachen nachweisbar</li><li>bildet verschiedene Enzyme</li><ul><li>Koagulase-positiv</li><li>Hämolysine</li><li>Kollagenase</li><li>Leukozidine</li></ul><li>Staph. aureus kann Biofilm bilden</li><li>Bakterium kann als "schlafender Phänotyp" im Gewebe persistieren = small colony variants</li><li>Möglichkeit der Ausbildung verschiedenster Resistenzmechanismen (MRSA)</li></ol> | ||
==Epidemiologie== | |||
Verschiedene Surveillance-Systeme in Deutschland und Europa erfassen regelmäßig Daten zur Resistenzsituation. Hier lässt sich seit einigen Jahren ein Rückgang Methicillin-resistenter Staphylocoocus aureus (MRSA) Stämme verzeichnen. Für Deutschland erfasst das Robert-Koch-Institut (RKI)<ref>Layer F, Strommenger B, Cuny C, Werner G: Eigenschaften, Häufigkeit und Verbreitung von MRSA in Deutschland – Zur Situation 2019/2020 | |||
Epid Bull 2021;40:3 -12 | DOI 10.25646/9007</ref> die Daten über das Antibiotika-Resistenz-Surveillance (ARS) Netzwerk aus der Routinediagnostik der stationären und ambulanten Versorgung. Die Ergebnisse des ARS für invasive Staph. aureus Isolate (Blutkulturen und Liquor) werden an das European Antimicrobial Resistance Surveillance Network (EARS-Net) weitergeleitet. | |||
Für Deutschland ergeben sich aus dem EARS-Net folgende Daten: | |||
<ul><li>signifikanter Rückgang des MRSA Anteils an allen Staph. aureus Isolden</li><li>12,8% in 2013</li><li>6,7% in 2019</li></ul> | |||
Zusätzlich ist in Deutschland der Nachweis von MRSA in Blutkulutren und Liquor seit 2009 laut Infektionsschutzgesetz meldepflichtig. Auch aus diesen Daten lässt sich ein signifikanter Rückgang der Fallzahlen beobachten: | |||
<ul><li>Inzidenz 2012 von 5,6 je 100.000 Einwohner</li><li>Inzidenz 2019 von 2,2 je 100.000 Einwohner</li></ul> | |||
<br> | |||
{| style="border: 1px solid #aaa; border-left: 10px solid #F28500; background: #fbfbfb;" | |||
|- | |||
| | |||
| class="mbox-image"| [[Image:Ambox_important_orange.svg.png|42px]] | |||
| style="padding: 0.25em 0.5em; width: 100%;" | Die Daten des EARS-Net zeigen unterschiedliche Verteilung in Europa auf<ul><li>Nordeuropa (Norwegen, Schweden) geringe MRSA-Raten</li><li>Süd- und Osteuropa (z.B. Italien, Griechenland, Rumänien, u.a.) hohe MRSA-Raten</li></ul> | |||
|} | |||
==Therapie Management== | ==Therapie Management== | ||
| Zeile 23: | Zeile 41: | ||
===Echokardiographie=== | ===Echokardiographie=== | ||
Jeder Patient mit Staph. aureus Nachweis in einer Blutkultur muss einer Echokardiographie erhalten. Dabei muss es nach der Arbeit von Thomas L Holland et al.<ref>Holland TL, Arnold C, Fowler VG Jr. Clinical management of Staphylococcus aureus bacteremia: a review. JAMA. 2014 Oct 1;312(13):1330-41. doi: 10.1001/jama.2014.9743. PMID: 25268440; PMCID: PMC4263314.</ref> nicht immer eine transösophagale (TEE) sein. Bei Patienten die folgende Kriterien erfüllen reicht eine transthorakale Echokardiographie (TTE). Allerdings sollte wie bei jeder anderen Erkrankung im stationären Verlauf die Entscheidung reevaluiert werden.<ul><li>sterile Blutkultur in der ersten Kontrolle nach 4 Tagen</li><li>keine vorhandenen (permanenten) intrakardialen Devices (Schrittmacherkabel, Herzklappenersatz, etc.)</li><li>keine dauerhafte Hämodialyse</li><li>keine klinischen | Jeder Patient mit Staph. aureus Nachweis in einer Blutkultur muss einer Echokardiographie erhalten. Dabei muss es nach der Arbeit von Thomas L Holland et al.<ref>Holland TL, Arnold C, Fowler VG Jr. Clinical management of Staphylococcus aureus bacteremia: a review. JAMA. 2014 Oct 1;312(13):1330-41. doi: 10.1001/jama.2014.9743. PMID: 25268440; PMCID: PMC4263314.</ref> nicht immer eine transösophagale (TEE) sein. Bei Patienten die folgende Kriterien erfüllen reicht eine transthorakale Echokardiographie (TTE). Allerdings sollte wie bei jeder anderen Erkrankung im stationären Verlauf die Entscheidung reevaluiert werden.<ul><li>sterile Blutkultur in der ersten Kontrolle nach 4 Tagen</li><li>keine vorhandenen (permanenten) intrakardialen Devices (Schrittmacherkabel, Herzklappenersatz, etc.)</li><li>keine dauerhafte Hämodialyse</li><li>keine klinischen Zeichen/Hinweise auf eine Endokarditis oder Vorhandensein anderer sekundärer Foci</li></ul> | ||
===Bildgebung=== | ===Bildgebung=== | ||
| Zeile 29: | Zeile 47: | ||
==Komplikationen== | ==Komplikationen== | ||
Zur Steuerung der Therapiedauer hat sich das Vorhandensein von Komplikationen etabliert. Bei einer unkomplizierten SAB ist eine Therapiedauer von 14 Tagen im Allgemeinen ausreichend, während bei einer "komplizierten" SAB 28 Tage und mehr notwendig sein können. Dabei richtet sich die | Zur Steuerung der Therapiedauer hat sich das Vorhandensein von Komplikationen etabliert. Bei einer unkomplizierten SAB ist eine Therapiedauer von 14 Tagen im Allgemeinen ausreichend, während bei einer "komplizierten" SAB 28 Tage und mehr notwendig sein können. Dabei richtet sich die Therapiedauer nach der Sanierbarkeit des Infektfokus. Hierzu sollten auch unbedingt aktuelle Therapieempfehlungen berücksichtigt werden: | ||
<ul><li>[[Endokarditis]]</li><li>[[Knochen- und Gelenkinfektionen]]</li></ul> | <ul><li>[[Endokarditis]]</li><li>[[Knochen- und Gelenkinfektionen]]</li></ul> | ||
So steigt das Risiko für Komplikationen bei Vorliegen von: <ul><li>Herzklappenersatz um 5-10%</li><li>Herzschrittmachern um 27-37%</li><li>Gelenkersatz um 29-39%</li><li>Osteosynthesematerial 7%</li><li> tiefsitzender primärer Fokus</li><li>positive Folgeblutkulturen nach 2-4 Tage nach initialer Blutkultur</li><li>keine Entfieberung innerhalb von 72 Stunden nach Therapiebeginn</li></ul><ref>OBEID, K.M., SZPUNAR, S. and KHATIB, R. (2012), Long-Term Outcomes of Cardiovascular Implantable Electronic Devices in Patients with Staphylococcus aureus Bacteremia. Pacing and Clinical Electrophysiology, 35: 961-965. https://doi.org/10.1111/j.1540-8159.2012.03438.x</ref><ref>Chamis AL, Peterson GE, Cabell CH, Corey GR, Sorrentino RA, Greenfield RA, Ryan T, Reller LB, Fowler VG Jr. Staphylococcus aureus bacteremia in patients with permanent pacemakers or implantable cardioverter-defibrillators. Circulation. 2001 Aug 28;104(9):1029-33. doi: 10.1161/hc3401.095097. PMID: 11524397.</ref><ref>David R. Murdoch, Sally A. Roberts, Vance G. Fowler, Jr., Manish A. Shah, Susan L. Taylor, Arthur J. Morris, G. Ralph Corey, Infection of Orthopedic Prostheses after Staphylococcus aureus Bacteremia, Clinical Infectious Diseases, Volume 32, Issue 4, 15 February 2001, Pages 647–649, https://doi.org/10.1086/318704</ref><ref>Lalani T, Chu VH, Grussemeyer CA, Reed SD, Bolognesi MP, Friedman JY, Griffiths RI, Crosslin DR, Kanafani ZA, Kaye KS, Ralph Corey G, Fowler VG Jr. Clinical outcomes and costs among patients with Staphylococcus aureus bacteremia and orthopedic device infections. Scand J Infect Dis. 2008;40(11-12):973-7. doi: 10.1080/00365540802245146. PMID: 18615359.</ref><ref>Sendi P, Banderet F, Graber P, Zimmerli W. Periprosthetic joint infection following Staphylococcus aureus bacteremia. J Infect. 2011 Jul;63(1):17-22. doi: 10.1016/j.jinf.2011.05.005. Epub 2011 May 14. PMID: 21663971.</ref> | So steigt das Risiko für Komplikationen bei Vorliegen von: <ul><li>Herzklappenersatz um 5-10%</li><li>Herzschrittmachern um 27-37%</li><li>Gelenkersatz um 29-39%</li><li>Osteosynthesematerial 7%</li><li> tiefsitzender primärer Fokus</li><li>positive Folgeblutkulturen nach 2-4 Tage nach initialer Blutkultur</li><li>keine Entfieberung innerhalb von 72 Stunden nach Therapiebeginn</li></ul><ref>OBEID, K.M., SZPUNAR, S. and KHATIB, R. (2012), Long-Term Outcomes of Cardiovascular Implantable Electronic Devices in Patients with Staphylococcus aureus Bacteremia. Pacing and Clinical Electrophysiology, 35: 961-965. https://doi.org/10.1111/j.1540-8159.2012.03438.x</ref><ref>Chamis AL, Peterson GE, Cabell CH, Corey GR, Sorrentino RA, Greenfield RA, Ryan T, Reller LB, Fowler VG Jr. Staphylococcus aureus bacteremia in patients with permanent pacemakers or implantable cardioverter-defibrillators. Circulation. 2001 Aug 28;104(9):1029-33. doi: 10.1161/hc3401.095097. PMID: 11524397.</ref><ref>David R. Murdoch, Sally A. Roberts, Vance G. Fowler, Jr., Manish A. Shah, Susan L. Taylor, Arthur J. Morris, G. Ralph Corey, Infection of Orthopedic Prostheses after Staphylococcus aureus Bacteremia, Clinical Infectious Diseases, Volume 32, Issue 4, 15 February 2001, Pages 647–649, https://doi.org/10.1086/318704</ref><ref>Lalani T, Chu VH, Grussemeyer CA, Reed SD, Bolognesi MP, Friedman JY, Griffiths RI, Crosslin DR, Kanafani ZA, Kaye KS, Ralph Corey G, Fowler VG Jr. Clinical outcomes and costs among patients with Staphylococcus aureus bacteremia and orthopedic device infections. Scand J Infect Dis. 2008;40(11-12):973-7. doi: 10.1080/00365540802245146. PMID: 18615359.</ref><ref>Sendi P, Banderet F, Graber P, Zimmerli W. Periprosthetic joint infection following Staphylococcus aureus bacteremia. J Infect. 2011 Jul;63(1):17-22. doi: 10.1016/j.jinf.2011.05.005. Epub 2011 May 14. PMID: 21663971.</ref> | ||
Das Erfüllen einer der Punkte aus der oben stehenden Liste macht aus einer unkomplizierten eine komplizierte SAB! | |||
==Hinweise zur Therapie== | ==Hinweise zur Therapie== | ||
| Zeile 39: | Zeile 57: | ||
===Inoculum Effekt=== | ===Inoculum Effekt=== | ||
Definition: Anstieg der Minimalen Hemmkonzentration (MHK), wenn die Anzahl der in die Blutbahn inokulierten Erreger erhöht wird (Beispiel: 100Tsd auf 10 Millionen, Anstieg der MHK um das | Definition: Anstieg der Minimalen Hemmkonzentration (MHK), wenn die Anzahl der in die Blutbahn inokulierten Erreger erhöht wird (Beispiel: 100Tsd auf 10 Millionen, Anstieg der MHK um das 4-fache (4 -> 16mg/L)). Durch den MHK Anstieg können einige als Staph. aureus sensibel getestete Antibiotika die nötige Konzentration nicht mehr erreichen und so "unwirksam" werden. Es besteht dabei kein Zusammenhang mit dem Infektfokus. | ||
Vor diesem Hintergrund wurden in den vergangenen Jahren zahlreiche Studien durchgeführt. Herauszuheben sind dabei die, welche Oxacillin mit Cafazollin verglichen. So konnte Jennifer S. McDane 2017 in einer retrospektiven Studie zeigen, dass die <ul><li>90 Tage Sterblichkeit | Vor diesem Hintergrund wurden in den vergangenen Jahren zahlreiche Studien durchgeführt. Herauszuheben sind dabei die, welche Oxacillin mit Cafazollin verglichen. So konnte Jennifer S. McDane 2017 in einer retrospektiven Studie zeigen, dass die <ul><li>90 Tage Sterblichkeit bei Therapie mit Cefazolin bei 20% und bei Oxacillin bei 25%</li><li>und die 30 Tage Sterblichkeit bei Therapie mit Cefazolin bei 10% und bei Oxacollin bei 15% </li></ul>lag.<ref>McDanel JS, Roghmann MC, Perencevich EN, Ohl ME, Goto M, Livorsi DJ, Jones M, Albertson JP, Nair R, O'Shea AMJ, Schweizer ML. Comparative Effectiveness of Cefazolin Versus Nafcillin or Oxacillin for Treatment of Methicillin-Susceptible Staphylococcus aureus Infections Complicated by Bacteremia: A Nationwide Cohort Study. Clin Infect Dis. 2017 Jul 1;65(1):100-106. doi: 10.1093/cid/cix287. PMID: 28379314.</ref> | ||
===Unterschied Nebenwirkungen=== | ===Unterschied Nebenwirkungen=== | ||
| Zeile 82: | Zeile 100: | ||
| class="mbox-image"| [[Image:Ambox_important_orange.svg.png|42px]] | | class="mbox-image"| [[Image:Ambox_important_orange.svg.png|42px]] | ||
| style="padding: 0.25em 0.5em; width: 100%;" | Aus den Daten lässt sich folgende Limitation ableiten:<ul><li>Einsatz von Flucloxacillin bevorzugt bei | | style="padding: 0.25em 0.5em; width: 100%;" | Aus den Daten lässt sich folgende Limitation ableiten:<ul><li>Einsatz von Flucloxacillin bevorzugt bei | ||
schwerer erkrankten Patienten</li><li>Einsatz von Cefazolin bei unkomplizierten | schwerer erkrankten Patienten</li><li>Einsatz von Cefazolin bei unkomplizierten Staph. aureus Bakteriämien möglich</li></ul> | ||
|} | |} | ||
<br /> | <br /> | ||
==Therapie== | ==Therapie== | ||
Es sei nochmals darauf hingewiesen, dass es sich bei der SAB um ein sehr ernst zu nehmendes Erkrankungsbild handelt. Es wird daher dringend empfohlen das ABS Team zu informieren! | Es sei nochmals darauf hingewiesen, dass es sich bei der SAB um ein sehr ernst zu nehmendes Erkrankungsbild handelt. Es wird daher dringend empfohlen das ABS Team zu informieren! | ||
| Zeile 99: | Zeile 118: | ||
|1. Wahl | |1. Wahl | ||
|Flucloxacillin | |Flucloxacillin | ||
| | |6 x 2g iv<br /> oder<br /> | ||
4 x 3g iv | |||
|14 Tage | |14 Tage | ||
|- | |- | ||
|Alternative | |Alternative | ||
|Cefazolin | |Cefazolin | ||
| | |3 x 2g iv | ||
|14 Tage | |14 Tage | ||
|- | |- | ||
| Zeile 112: | Zeile 131: | ||
|1. Wahl | |1. Wahl | ||
|Flucloxacillin | |Flucloxacillin | ||
| | |6 x 2g iv<br /> oder<br /> | ||
4 x 3g iv | |||
|14 Tage | |14 Tage | ||
|} | |} | ||
| Zeile 123: | Zeile 142: | ||
| '''Substanz''' | | '''Substanz''' | ||
|'''Dosierung''' | |'''Dosierung''' | ||
| style="width:5em;" |'''Dauer''' | | style="width:5em;" |'''Dauer''' | ||
|- | |- | ||
|1. Wahl | |1. Wahl | ||
|Vancomycin | |||
|Initialdosis: 1000 mg | |||
Talspiegel: 15-20 mg/l<br /> | |||
[[Medium:Dosierschema Vancomycin UEK.pdf|Dosierschema Vancomycin]] | |||
|mind. 14 Tage | |||
|- | |||
|Alterantiv | |||
|Daptomycin | |Daptomycin | ||
|8 mg/kg/24 h iv | |8 mg/kg/24 h iv | ||
|mind. 14 Tage | |mind. 14 Tage | ||
|} | |} | ||
Aktuelle Version vom 5. April 2024, 06:16 Uhr
zurück zur Übersichtsseite
Die Staphylococcus aureus Bakteriämie (SAB) ist nach Bakteriämien durch E. coli die zweithäufigste Blutstrominfektion mit einer Inzidenz von 20-30/100.000 Einwohner. Eine Infektion ist nicht nur häufig, sie ist zudem auch mit einer hohen Sterblichkeit assoziiert. Lag die Letalität bis 1960 noch bei 80% konnte diese durch Entwicklung neuer Antibiotika deutlich gesenkt werden. Dennoch liegt sie immer noch zwischen 20-30%. Sekundäre Foci (in 30-40% der Fälle) und eine Rezidivrate von 10% erschweren häufig die Therapie. Die SAB erfordert somit eine zeitnahe erregergerechte Therapie und eine konsequente Diagnostik und sollte im Idealfall durch einen ABS Experten begleitet werden.
Erreger
- grampositives kugelförmiges Bakterium
- fakultativ pathogen
- mikroskopische Darstellung als Haufenkokken
- bei ca. 20% der Bevölkerung auf Haut und im Rachen nachweisbar
- bildet verschiedene Enzyme
- Koagulase-positiv
- Hämolysine
- Kollagenase
- Leukozidine
- Staph. aureus kann Biofilm bilden
- Bakterium kann als "schlafender Phänotyp" im Gewebe persistieren = small colony variants
- Möglichkeit der Ausbildung verschiedenster Resistenzmechanismen (MRSA)
Epidemiologie
Verschiedene Surveillance-Systeme in Deutschland und Europa erfassen regelmäßig Daten zur Resistenzsituation. Hier lässt sich seit einigen Jahren ein Rückgang Methicillin-resistenter Staphylocoocus aureus (MRSA) Stämme verzeichnen. Für Deutschland erfasst das Robert-Koch-Institut (RKI)[1] die Daten über das Antibiotika-Resistenz-Surveillance (ARS) Netzwerk aus der Routinediagnostik der stationären und ambulanten Versorgung. Die Ergebnisse des ARS für invasive Staph. aureus Isolate (Blutkulturen und Liquor) werden an das European Antimicrobial Resistance Surveillance Network (EARS-Net) weitergeleitet.
Für Deutschland ergeben sich aus dem EARS-Net folgende Daten:
- signifikanter Rückgang des MRSA Anteils an allen Staph. aureus Isolden
- 12,8% in 2013
- 6,7% in 2019
Zusätzlich ist in Deutschland der Nachweis von MRSA in Blutkulutren und Liquor seit 2009 laut Infektionsschutzgesetz meldepflichtig. Auch aus diesen Daten lässt sich ein signifikanter Rückgang der Fallzahlen beobachten:
- Inzidenz 2012 von 5,6 je 100.000 Einwohner
- Inzidenz 2019 von 2,2 je 100.000 Einwohner
Therapie Management
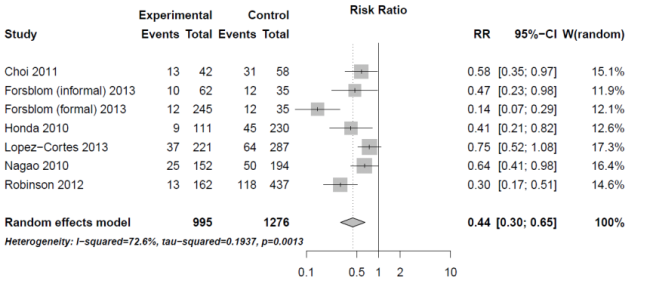
Aufgrund der hohen Letalität und der zahlreichen möglichen Komplikationen ist ein Therapie Management obligat.
- Fokussuche
- Fokussanierung
- Auswahl des richtigen Antibiotikums
- richtige Dosierung
- Therapiekontrolle (Blutkulturen)
- Therapiedauer
Statistisch kann ein Therapie Management die Sterblichkeit um ca. 50% reduzieren.[2]
Bildquelle siehe Vogel et al. unter [1]
Fokussuche
Bei erst- und einmaligen Nachweis von Staph. aureus in einer Blutkultur (MSSA oder MRSA) gilt die Diagnose als gesichert. Dieser muss sich die Fokus Identifizierung, falls nicht bereits bekannt, anschließen.
Blutkulturen
Diese Hinweise gelten generell und sollten somit bei der Abnahme jedweder Blutkulturen beachtet werden!
- Abnahme der Blutkulturen vor Erstgabe eines Antibiotikums
- sollte bereits ein Antibiotikum verabreicht worden sein, Eintrag in Anforderung mit Angabe des Antibiotikums
- Beimpfung von 2 Paar Blutkulturflaschen (2x aerob, 2x anaerob)
- Blutabnahme nicht aus liegenden Gefäßzugängen. Ausnahme: frisch gelegte
- Blutabnahme von unterschiedlichen Punktionsorten Beimpfung der Blutkulturflaschen mit 8 bis 10 ml Blut
- zwingende Einhaltung der allgemeinen Hygieneregeln (vermeide Kontamination!)
- Desinfektion der Einspritzgummis an den Blutkulturflaschen
- kein Einbringen von Luft in Blutkulturflaschen, auch nicht in die aerobe Flasche!
- keine Verzögerung der Blutentnahme durch warten auf Fieber!
- umgehender Transport ins Labor
Echokardiographie
Jeder Patient mit Staph. aureus Nachweis in einer Blutkultur muss einer Echokardiographie erhalten. Dabei muss es nach der Arbeit von Thomas L Holland et al.[3] nicht immer eine transösophagale (TEE) sein. Bei Patienten die folgende Kriterien erfüllen reicht eine transthorakale Echokardiographie (TTE). Allerdings sollte wie bei jeder anderen Erkrankung im stationären Verlauf die Entscheidung reevaluiert werden.
- sterile Blutkultur in der ersten Kontrolle nach 4 Tagen
- keine vorhandenen (permanenten) intrakardialen Devices (Schrittmacherkabel, Herzklappenersatz, etc.)
- keine dauerhafte Hämodialyse
- keine klinischen Zeichen/Hinweise auf eine Endokarditis oder Vorhandensein anderer sekundärer Foci
Bildgebung
Je nach vorliegenden Verdachtsfällen auf sekundäre oder andere Foci ist eine Stufendiagnostik bis zur CT/MRT oder gar eines FDG//PET-CT zur Fokussuche indiziert.
Komplikationen
Zur Steuerung der Therapiedauer hat sich das Vorhandensein von Komplikationen etabliert. Bei einer unkomplizierten SAB ist eine Therapiedauer von 14 Tagen im Allgemeinen ausreichend, während bei einer "komplizierten" SAB 28 Tage und mehr notwendig sein können. Dabei richtet sich die Therapiedauer nach der Sanierbarkeit des Infektfokus. Hierzu sollten auch unbedingt aktuelle Therapieempfehlungen berücksichtigt werden:
So steigt das Risiko für Komplikationen bei Vorliegen von:
- Herzklappenersatz um 5-10%
- Herzschrittmachern um 27-37%
- Gelenkersatz um 29-39%
- Osteosynthesematerial 7%
- tiefsitzender primärer Fokus
- positive Folgeblutkulturen nach 2-4 Tage nach initialer Blutkultur
- keine Entfieberung innerhalb von 72 Stunden nach Therapiebeginn
Das Erfüllen einer der Punkte aus der oben stehenden Liste macht aus einer unkomplizierten eine komplizierte SAB!
Hinweise zur Therapie
Zur Therapie eignen sich nur Staphylokokken-wirksame Antibiotika. Hier sollte nicht nur auf das Resistogramm geachtet werden. Viele Kliniken/Labore, wie auch bei uns, sind dazu übergegangen bei SAB ein Erregerspezifisches Resistogramm zu übermitteln. Ein wichtiger Grund hierfür ist der Inoculum Effekt.
Inoculum Effekt
Definition: Anstieg der Minimalen Hemmkonzentration (MHK), wenn die Anzahl der in die Blutbahn inokulierten Erreger erhöht wird (Beispiel: 100Tsd auf 10 Millionen, Anstieg der MHK um das 4-fache (4 -> 16mg/L)). Durch den MHK Anstieg können einige als Staph. aureus sensibel getestete Antibiotika die nötige Konzentration nicht mehr erreichen und so "unwirksam" werden. Es besteht dabei kein Zusammenhang mit dem Infektfokus.
Vor diesem Hintergrund wurden in den vergangenen Jahren zahlreiche Studien durchgeführt. Herauszuheben sind dabei die, welche Oxacillin mit Cafazollin verglichen. So konnte Jennifer S. McDane 2017 in einer retrospektiven Studie zeigen, dass die
- 90 Tage Sterblichkeit bei Therapie mit Cefazolin bei 20% und bei Oxacillin bei 25%
- und die 30 Tage Sterblichkeit bei Therapie mit Cefazolin bei 10% und bei Oxacollin bei 15%
lag.[9]
Unterschied Nebenwirkungen
Bezüglich der Nebenwirkungen kamen Khalid Eljaaly et al.[10] auf folgendes Ergebnis:
| Unterschied Nebenwirkungen | ||
|---|---|---|
| Flucloxacillin | Cefazolin | |
| Hepatotoxizität | 39% | 15% |
| Nephrotoxizität | 7.6% | 0.8% |
| Nebenwirkungen | 11.2% | 1,5% |
| Inoculum Effekt | keiner | vorhanden |
| Thrombopenie | kein Unterschied | |
| Neutropenie | kein Unterschied | |
| C. diff. Häufigkeit | kein Unterschied | |
Therapie
Es sei nochmals darauf hingewiesen, dass es sich bei der SAB um ein sehr ernst zu nehmendes Erkrankungsbild handelt. Es wird daher dringend empfohlen das ABS Team zu informieren!
| SAB bei MSSA | |||
|---|---|---|---|
| Präferenz | Substanz | Dosierung | Dauer |
| SAB ohne Komplikationen | |||
| 1. Wahl | Flucloxacillin | 6 x 2g iv oder 4 x 3g iv |
14 Tage |
| Alternative | Cefazolin | 3 x 2g iv | 14 Tage |
| SAB mit Komplikationen | |||
| 1. Wahl | Flucloxacillin | 6 x 2g iv oder 4 x 3g iv |
14 Tage |
| SAB bei MRSA | |||
|---|---|---|---|
| Präferenz | Substanz | Dosierung | Dauer |
| 1. Wahl | Vancomycin | Initialdosis: 1000 mg
Talspiegel: 15-20 mg/l |
mind. 14 Tage |
| Alterantiv | Daptomycin | 8 mg/kg/24 h iv | mind. 14 Tage |
Quellen
- ↑ Layer F, Strommenger B, Cuny C, Werner G: Eigenschaften, Häufigkeit und Verbreitung von MRSA in Deutschland – Zur Situation 2019/2020 Epid Bull 2021;40:3 -12 | DOI 10.25646/9007
- ↑ Vogel M, Schmitz RP, Hagel S, Pletz MW, Gagelmann N, Scherag A, Schlattmann P, Brunkhorst FM. Infectious disease consultation for Staphylococcus aureus bacteremia - A systematic review and meta-analysis. J Infect. 2016 Jan;72(1):19-28. doi: 10.1016/j.jinf.2015.09.037. Epub 2015 Oct 9. PMID: 26453841.
- ↑ Holland TL, Arnold C, Fowler VG Jr. Clinical management of Staphylococcus aureus bacteremia: a review. JAMA. 2014 Oct 1;312(13):1330-41. doi: 10.1001/jama.2014.9743. PMID: 25268440; PMCID: PMC4263314.
- ↑ OBEID, K.M., SZPUNAR, S. and KHATIB, R. (2012), Long-Term Outcomes of Cardiovascular Implantable Electronic Devices in Patients with Staphylococcus aureus Bacteremia. Pacing and Clinical Electrophysiology, 35: 961-965. https://doi.org/10.1111/j.1540-8159.2012.03438.x
- ↑ Chamis AL, Peterson GE, Cabell CH, Corey GR, Sorrentino RA, Greenfield RA, Ryan T, Reller LB, Fowler VG Jr. Staphylococcus aureus bacteremia in patients with permanent pacemakers or implantable cardioverter-defibrillators. Circulation. 2001 Aug 28;104(9):1029-33. doi: 10.1161/hc3401.095097. PMID: 11524397.
- ↑ David R. Murdoch, Sally A. Roberts, Vance G. Fowler, Jr., Manish A. Shah, Susan L. Taylor, Arthur J. Morris, G. Ralph Corey, Infection of Orthopedic Prostheses after Staphylococcus aureus Bacteremia, Clinical Infectious Diseases, Volume 32, Issue 4, 15 February 2001, Pages 647–649, https://doi.org/10.1086/318704
- ↑ Lalani T, Chu VH, Grussemeyer CA, Reed SD, Bolognesi MP, Friedman JY, Griffiths RI, Crosslin DR, Kanafani ZA, Kaye KS, Ralph Corey G, Fowler VG Jr. Clinical outcomes and costs among patients with Staphylococcus aureus bacteremia and orthopedic device infections. Scand J Infect Dis. 2008;40(11-12):973-7. doi: 10.1080/00365540802245146. PMID: 18615359.
- ↑ Sendi P, Banderet F, Graber P, Zimmerli W. Periprosthetic joint infection following Staphylococcus aureus bacteremia. J Infect. 2011 Jul;63(1):17-22. doi: 10.1016/j.jinf.2011.05.005. Epub 2011 May 14. PMID: 21663971.
- ↑ McDanel JS, Roghmann MC, Perencevich EN, Ohl ME, Goto M, Livorsi DJ, Jones M, Albertson JP, Nair R, O'Shea AMJ, Schweizer ML. Comparative Effectiveness of Cefazolin Versus Nafcillin or Oxacillin for Treatment of Methicillin-Susceptible Staphylococcus aureus Infections Complicated by Bacteremia: A Nationwide Cohort Study. Clin Infect Dis. 2017 Jul 1;65(1):100-106. doi: 10.1093/cid/cix287. PMID: 28379314.
- ↑ Eljaaly K, Alshehri S, Erstad BL. Systematic Review and Meta-analysis of the Safety of Antistaphylococcal Penicillins Compared to Cefazolin. Antimicrob Agents Chemother. 2018 Mar 27;62(4):e01816-17. doi: 10.1128/AAC.01816-17. PMID: 29437617; PMCID: PMC5913998.