Intraabdominelle Infektionen (IAI): Unterschied zwischen den Versionen
(Die Seite wurde neu angelegt: „'''zurück zur Übersichtsseite'''<br> <br /><br /> {| style="border: 1px solid #aaa; border-left: 10px solid #36c; background: #fbfbfb;" |- | | class="mbox-image" | 42px|verweis=Special:FilePath/512px-Ambox_important_blue.svg.png | style="padding: 0.25em 0.5em; width: 100%;" |'''Bitte beachten Sie: '''Diese Informationen richten sich ausschließlich an ärztliches Fachpersonal. Beachten…“) |
(kein Unterschied)
|
Version vom 7. Mai 2022, 08:44 Uhr
zurück zur Übersichtsseite
| Bitte beachten Sie: Diese Informationen richten sich ausschließlich an ärztliches Fachpersonal. Beachten Sie hierzu auch unsere Nutzungsbedingungen! |
Intraabdominelle Infektionen (IAI) treten im klinischen Setting häufig auf und zählen zu den wichtigsten Verursachern einer Sepsis. Dabei ist das Erregerspektrum sehr breit und reicht von einem heterogenen bis polymikrobiellen Spektrum, welches sich in der Zusammensetzung von oral nach aboral ändert. Zusätzlich kann es zum Auftreten multiresistenter Erreger kommen.
Risikoabschätzung
Zur Bewertung der Letalität hat sich in mehreren Studien der validierte Mannheimer Peritonitis Index [1] (MPI) bewährt.
| Risikofaktor | Punkte | |
| Alter > 50 Jahre | 5 | |
| Geschlecht weiblich | 5 | |
| Organversagen | 7 | |
| Malignom | 4 | |
| Dauer der Peritonitis vor der OP > 24h | 4 | |
| Ausgangspunkt ist nicht der Dickdarm | 4 | |
| diffuse Ausbreitung | 6 | |
| Exsudat | ||
| klar | 0 | |
| trüb-eitrig | 6 | |
| kotig-jauchig | 12 | |
Auswertung:
- bei einem MPI von ≤ 20 liegt die Letalität bei nahezu 0%
- bei einem MPI zwischen 21 und 28 liegt die Letalität bei 23%
- bei einem MPI ≥ 29 liegt die Letalität bei über 50%
klinische Einteilung
Die Peritonitis kann nach Ursache und nach Ausdehnung unterteilt werden:
Einteilung nach Ursache
- Primäre Peritonitis (ca. 1%)
- Spontan bakterielle Peritonitis
- Peritonitis bei Peritonealdialyse
- Sekundäre Peritonitis (ca. 80-90%)
- ambulant erworben nach Hohlorganperforation
- postoperativ (postinterventionell/ posttraumatisch)
- Tertiäre Peritonitis (ca. 5-10%)
- persistierende intraabdominelle Infektion ohne chirurgisch sanierbaren Fokus
Einteilung nach Ausdehnung
- unkomplizierte IAI
- maximal ein Organ betroffen
- Peritoneum nicht involviert
- komplizierte IAI
- Infektion überschreitet das betroffene Organ
- ein oder mehrere Organe betroffen
- lokalisierte oder diffuse Peritonitis
Diagnostik
Die Diagnostik besteht zum einen aus einer der klinischen Situation angemessenen Bildgebung sowie laborchemischer Bestimmung von Entzündungsparameter. Zudem ist eine je nach vorliegender Infektion entsprechende Gewinnung mikrobiologischer Proben unabdingbar.
Labor
- CRP
- ggf. PCT
- kleines Blutbild
- bei septischen Erkrankungsbild Diff. BB.
- Gerinnung (bei Sepsis Fibrinogen)
Mikrobiologie
- unkomplizierte (ambulant erworbene) IAI
- eine mikrobiologische Probengewinnung nicht erforderlich
- Appendizitis, Cholezystitis, Divertikulitis
- komplizierte IAI
- primäre Peritonitis
- sekundäre Peritonitis
- tertiäre Peritonitis
Qualitätsindikatoren
- mind. 1-2 ml Peritonealflüssigkeit/Eiter und/oder Gewebe nativ
- Abstriche sind Flüssigkeits- und Gewebeproben deutlich unterlegen
- Abnahme von Blutkulturen (mind. 2 Paar)
- präzise Anforderung/ Materialbezeichnung
- möglichst kurze Transportzeiten
Erreger
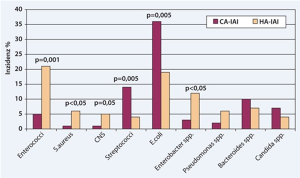
Das oft polymikrobielle Bild einer IAI setzt sich aus Kommensalen des GI-Traktes zusammen und variiert ja nach Ort der Ursache für die IAI.[2]
spontan bakterielle Peritonitis:
- E. coli
- Klebsiella spp.
- Staphylokokken
- Enterokokken
- Streptokokken
- bei Peritonealdialyse (PD) Hautkommensalen, z.B. Staphylokokken, Streptokokken
sekundäre, komplizierte Peritonitis:
- Enterobakterien
- Pseudomonas aeruginosa
- Acinetobacter spp.
- Streptokokken
- Enterokokken
- Staphylokokken
- Bacteroides spp.
- Candida spp.
Verteilungshäufigkeit Candida spp.:[3]
- C. albicans 58,5%
- C. glabrata 19,1%
- C. parapsilosis 8,0%
- C. tropicalis 7,5%.
primäre juvenile Peritonitis:
- A-Streptokokken
- Pneumokokken
- seltener Haemophilus influenzae
Häufigkeit MRE[4]
- ambulant erworbene IAI 7,8%
- nosokomial früh erworbene IAI 15,4%
- nosokomial spät erworbene IAI 9,8%
Therapie
Die Auswahl des Richtigen Antibiotikums richtet sich zunächst nach der Klassifikation (Ort der Entstehung, Ausdehnung, Dauer und Schweregrad). Im nächsten Schritt muss evaluiert werden, ob ein Risiko für eine MRE Besiedelung und/oder Enterokokken besteht. Die folgenden Tabellen entstammen zum Teil der infektiopedia.de der Deutschen Gesellschaft für Infektiologie (DGI).
Schritt 1:
| Kategorie 1:
Basisspektrum; gram-positiv/–negativ, anaerob |
Kategorie 2:
Zusätzlich zu Kategorie 1: nosokomial gram-negativ + Enterokokken |
Kategorie 3:
Zusätzlich zu Kategorie 2: Candida spp. |
| Mild
(Infektion) |
Moderat
(Sepsis) |
Schwer
(Sept. Schock) | ||
|---|---|---|---|---|
| Ambulant erworben oder IAI frühe nosokomiale IAI
(<7d nach Krankenhaus Aufnahme) |
Ohne Perforation | 1 | 1 | 2 |
| Lokale Peritonitis | 1 | 1 | 2 | |
| Diffuse Peritonitis | 1 | 2 | 2 | |
| Späte nosokomiale IAI
(>7d nach Krankenhaus Aufnahme) |
Ohne Perforation | 2 | 2 | 2 |
| Lokale Peritonitis | 2 | 2 | 3 | |
| Diffuse Peritonitis | 2 | 3 | 3 | |
2. Schritt
| MRE | Enterokokken |
|---|---|
|
|
3. Schritt
| Therapie der IAI nach Kategorie 1 | |||||
|---|---|---|---|---|---|
| Präferenz | Substanz | Dosierung | iv/po | Dauer | Anpassungen |
| 1. Wahl | Cefuroxim plus Metronidazol |
3x 1,5g plus 2x 500mg |
iv | 3-5 d | DANI GFR > 20: 100% |
| Alternative | Ceftriaxon plus Metronidazol |
3x 2g plus 2x 500mg |
iv | 3-5 d | DANI > 10: 100% DANI GFR > 20: 100% |
| bei Penicillin-Allergie | Ciprofloxacin plus Metronidazol |
3x 400mg plus 2x 500mg |
iv | 3-5 d | DANI GFR > 60: 100% DANI GFR > 20: 100% |
| Therapie der IAI nach Kategorie 2 | |||||
|---|---|---|---|---|---|
| Präferenz | Substanz | Dosierung | iv/po | Dauer | Anpassungen |
| 1. Wahl | Piperazillin/
Tazobactam |
3 bis 4x
4,5g |
iv | 7 d* | DANI GFR > 40: 100% |
| bei Penicillin-Allergie | Ciprofloxacin plus Metronidazol |
3x 400mg plus 2x 500mg |
iv | 7 d* | DANI GFR > 60: 100% DANI GFR > 20: 100% |
| Therapie der IAI nach Kategorie 3 | |||||
|---|---|---|---|---|---|
| Präferenz | Substanz | Dosierung | iv/po | Dauer | Anpassungen |
| 1. Wahl | Meronem | 3x 2g | iv | 7 d* | DANI GFR > 50: 100% |
| Alternative | Imipenem | 3x 1g | iv | 7 d* | DANI GFR > 70: 100% |
| ggf zusätzlich | Caspufungin | d1: 70mg
dann: < 80kg: 50mg >80kg: 70mg |
iv | 7 d | DANI nicht erforderlich |
Therapie bei MRE
| Erreger | Variante | Präparat | ||||||
|---|---|---|---|---|---|---|---|---|
| Ceftazidim/ Avibactam | Ceftolozan/ Tazobactam | Imipenem/ Relebactam | Meropenem/ Varbobactam | Colisitin | Cefiderocol | Ceftobiprol | ||
| Pseudomonas aerugionsa | Wildtyp | |||||||
| AmpC | ||||||||
| Porinverlust (oprD-loss) | ||||||||
| Effluxpumpen | ||||||||
| Carbapenem-R (Ø Carbapenemase) | ||||||||
| MBL+ | ||||||||
| Entero-bacteriaceae | Wildtyp | |||||||
| ESBL+ | ||||||||
| OXA-48-like+ | ||||||||
| KPC | ||||||||
| Carbapenem-R (Ø Carbapenemase) | ||||||||
| MBL+ (VIM,IMP,NDM) | ||||||||
| Acinetobacter baumannii | Wildtyp | |||||||
| Carbapenem-R | ||||||||
| Steno-trophomonas maltophilia | Wildtyp | |||||||
| Carbapenem-R | ||||||||
antimykotische Therapie
Die antimykotische Therapie wird immer wider kontrovers diskutiert und sollte bei Patient:innen der Kategorie 1 und 2 in der Regel nicht zur Anwendung kommen. Bei schweren oder komplizierten Verläufen kann eine Therapie erwogen werden. Ziel einer empirischen antimykotischen Therapie ist die Vermeidung einer invasiven Candidiasis.
Risikofaktoren für eine invasive Candidiasis:
- lang andauernde Antibiotika Therapie
- zentralvenöser Katheter
- parenterale Ernährung
- Komplizierte abdominalchirurgische Eingriffe (in der Regel nach Hohlorganperforation)
- systemische Gabe von Glucocorticoiden
- Akutes Nierenversagen oder eine chronische Dialyse
- Protrahierte Granulozytopenie
Therapie
Grundsätzlich sollte die antimykotische Therapie bei intraabdominellen Infektionen mit einem Echinocandin erfolgen.
| Präparat | Erreger | |||||
|---|---|---|---|---|---|---|
| Candida albicans | Candida glabrata | Candida parapsilosis | Candida krusei | Aspergillus fumigatus | Aspergillus niger | |
| Fluconazol | intrinsisch R | intrinsisch R | ||||
| Voriconazol | etwas besser als Fluco. | |||||
| Isavuconazol | Caspu. nicht unterlegen | |||||
| Caspofungin | nicht ausreichend | |||||
| Anidulafungin | nicht ausreichend | |||||
| Micafungin | nicht ausreichend | |||||
| Liposomales Amphotericin B | hohe Dosis erforderlich | |||||
| wirksam | |
| resistent | |
| nicht wirksam | |
| siehe Tabelle oben |
Dauer der Therapie
- bei klinisch stabilen Patienten ohne Sepsis und erfolgter Fokuskontrolle/-sanierung kann die Therapie nach drei bis fünf Tagen beendet werden
- bei Patient:innen mit saniertem Fokus ist eine Therapie > 7 Tage kritisch zu betrachten
- Ausnahme: Staph aureus oder Pseudomonas aeroginosa Infektion
- bei schwer kranken Patient:innen ohne Möglichkeit der stabilen Fokussanierung täglich kritische Re-Evaluierung der Antibiotika Therapie, Steuerung mittels PCT
- bei antimykotischer Therapie Therapieziel fünf Tage, Ausnahme Blutstrominfektion
- bei Blutstrominfektion: Therapie bis 14 Tage nach letztem Nachweis in der Blutkultur
Quellen
- ↑ Bosscha K, Reijnders K, Hulstaert PF, Algra A, van der Werken C. Prognostic scoring systems to predict outcome in peritonitis and intra-abdominal sepsis. Br J Surg. 1997;84(11):1532-1534
- ↑ Blot S, De Waele JJ. Critical issues in the clinical management of complicated intra-abdominal infections. Drugs. 2005;65(12):1611-1620. doi:10.2165/00003495-200565120-00002
- ↑ Ruhnke M, Rickerts V, Cornely OA, et al.: Diagnosis and therapy of Candida infections: joint recommendations of the German Speaking Mycological Society and the Paul-Ehrlich-Society for Chemotherapy. Mycoses 2011; 54: 279-310
- ↑ Sawyer RG, Claridge JA, Nathens AB, et al. Trial of short-course antimicrobial therapy for intraabdominal infection. N Engl J Med. 2015;372(21):1996-2005. doi:10.1056/NEJMoa1411162